Der globale Zell- und Genmarkt, der im Jahr 2023 auf 9,95 Mrd. USD geschätzt wird, ist eine schnell wachsende Branche, die bis 2033 auf 106,03 Mrd. USD anwachsen soll. Die Daten für das dritte Quartal 2023 zeigen, dass weltweit über 1.800 klinische Zell- und Genversuche mit einer Gesamtinvestition von 2,2 Mrd. USD durchgeführt werden. Von den 1.804 Studien gab es in Nordamerika mit 940 die meisten laufenden Studien, gefolgt von 747 im asiatisch-pazifischen Raum und 340 in Europa.
Da die Branche noch in den Kinderschuhen steckt, gibt es bei der Organisation der Logistik für Zell- und Gentherapien einige besondere Schwierigkeiten. In diesem Artikel befassen wir uns mit den logistischen Herausforderungen, die sich während des gesamten Zyklus der klinischen Prüfung von Zell- und Gentherapien stellen, sowie mit den wichtigsten Überlegungen, die Entwickler und Hersteller von Zell- und Gentherapien beachten müssen.
Was ist Zell- und Gentherapie?
Zelltherapie und Gentherapie sind zwei unterschiedliche Behandlungsmethoden. Bei der Gentherapie werden normale Gene in Zellen eingebracht, um „defekte“ Gene zu ersetzen und so genetische Störungen zu behandeln. Bei der Zelltherapie werden einem Patienten lebende Zellen zur Behandlung von Krankheiten übertragen. Die Zellen können vom Patienten selbst (autologe Zellen) oder von einem Spender (allogene Zellen) stammen.
Der Hauptunterschied zwischen Zell- und Gentherapie besteht darin, dass bei der Gentherapie genetisches Material in einem Träger oder „Vektor“ übertragen wird und dieses Gen in die Zellen des Patienten eingebracht wird, während bei der Zelltherapie veränderte Zellen in den Patienten eingebracht werden. Zell- und Gentherapie sind zwar zwei getrennte Verfahren, werden aber häufig zusammen eingesetzt, so z. B. bei der Stammzellenbehandlung, bei der die Stammzellen genetisch verändert und dem Patienten wieder eingesetzt werden.
Wie die personalisierte Medizin sind auch die Zell- und Gentherapien hochspezialisiert und auf die Bedürfnisse des einzelnen Patienten abgestimmt. Bei derart spezialisierten Behandlungen besteht ein inhärenter Bedarf an spezifischen und maßgeschneiderten Logistikdienstleistungen, um den Anforderungen der Branche gerecht zu werden. Die Fähigkeit, Daten während des gesamten Transports der Nutzlast vom Lager bis zum endgültigen Bestimmungsort zu verfolgen und zu verwalten, wird ein entscheidender Schritt sein, um den sicheren Transport von Zell- und Gentherapien zu gewährleisten.
Wie sieht die Roadmap der Zell- und Gentherapie aus?
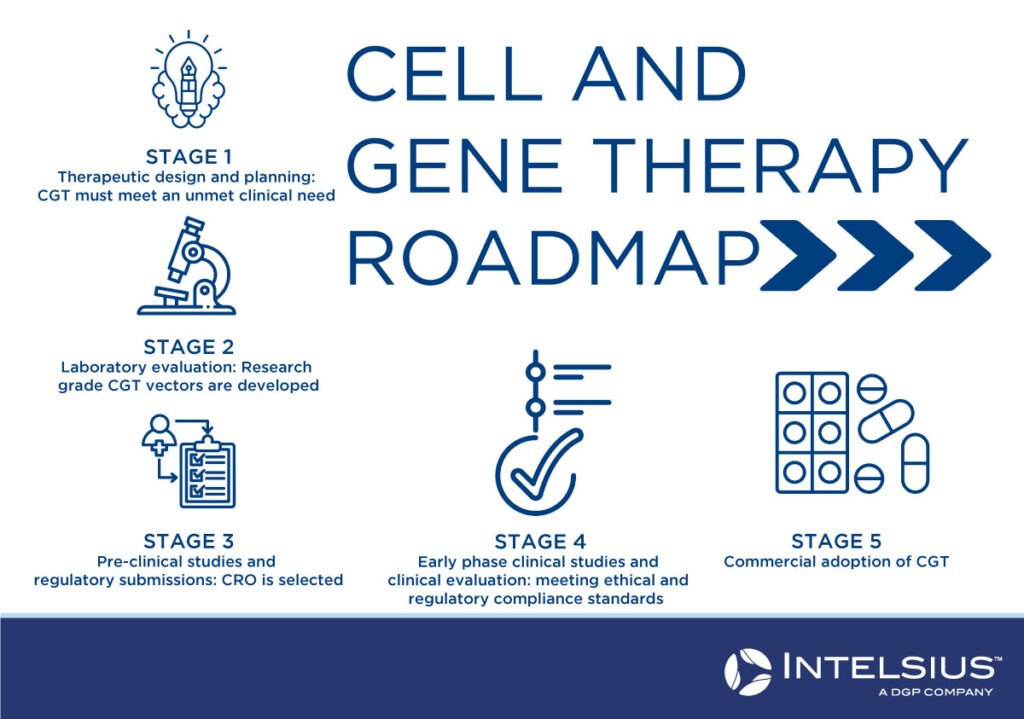
Stufe 1: Konzeption und Planung
Ermittlung des Nutzens der vorgeschlagenen Zell- und Gentherapie im Vergleich zu den derzeit verfügbaren Behandlungen und Bewertung der wichtigsten technischen, wissenschaftlichen und medizinischen Informationen, die erforderlich sind, um die Anforderungen der Aufsichtsbehörden und der Geldgeber zu erfüllen. Die Finanzierung ist ein wichtiger Aspekt, um eine ausreichende Finanzierung des gesamten Projekts, einschließlich der Forschungs-, Produktions- und Personalkosten, sicherzustellen. In dieser Phase werden auch Fragen des geistigen Eigentums und Anträge auf den Status eines Arzneimittels für seltene Krankheiten behandelt.
Phase 2: Bewertung im Labor
Zell- und Gentherapievektoren in Forschungsqualität müssen entwickelt werden, um sicherzustellen, dass der Vektor stabil ist, alle wesentlichen Anforderungen erfüllt und dem angestrebten Produktprofil entspricht. Er muss auch für die präklinische Bewertung ausreichen. Die potenzielle Therapie muss in dieser Phase den behördlichen Richtlinien und Anforderungen entsprechen.
Stufe 3: Präklinische Studien
Ein Auftragsforschungsinstitut (CRO) wird mit der Durchführung der Forschung auf vertraglicher Basis beauftragt, um die klinische Forschung, die Vorbereitungen für die klinische Prüfung und die regulatorischen Angelegenheiten zu unterstützen. In dieser Phase wird ein Antrag für eine klinische Studie bei der zuständigen Behörde eingereicht.
Stufe 4: Klinische Studien in der Frühphase
In dieser Phase werden die behördlichen und ethischen Anforderungen erfüllt, damit die klinischen Studien der Phasen 1 und 2 durchgeführt werden können. Während in den klinischen Studien der Phase 1 die Sicherheit der Therapie untersucht wird, konzentrieren sich die Studien der Phase 2 mehr auf die Wirksamkeit bei den Patienten.
Phase 5: Kommerzielle Einführung
In der letzten Phase der CGT-Zulassung werden klinische Studien der Phasen 3 und 4 durchgeführt, um die Wirksamkeit und Sicherheit der Behandlung an einer größeren Bevölkerungsgruppe zu testen. In dieser Phase werden die kommerziellen Herstellungsverfahren festgelegt, die schließlich zur Übernahme in das nationale Gesundheitssystem und/oder für den öffentlichen Verbrauch führen.
Während des gesamten Prozesses der Arzneimittelentdeckung werden Patientenzellen hin- und herbefördert, manchmal zu mehreren Prüfstellen im Gesundheitswesen, bevor sie an den Hersteller geliefert werden. Da lebende Zellen während des Transports bei bestimmten Temperaturen bleiben müssen, um ihre Integrität zu bewahren, sind Kühlkettenlogistik, Verpackung und Lagerung Schlüsselfaktoren, die sorgfältig berücksichtigt werden müssen.
Welche Rolle spielt die temperaturgesteuerte Logistik bei Zell- und Gentherapien?
Hauptüberlegungen zur Logistik der Zell- und Gentherapie:
- Verbundene Logistik
- Einhaltung von Vorschriften
- Die Auswahl der richtigen Verpackung
- Die Komplexität der Lieferketten
Vernetzte Logistik
Zell- und Gentherapien dienen der Behandlung seltener Krankheiten. Klinische Versuche zur Behandlung seltener Krankheiten werden zweifellos über verschiedene Standorte und sogar Kontinente verteilt sein. Dies ist eine Herausforderung, die ein extrem gut vernetztes und stabiles Logistiknetz erfordert, in dem die Partner der Lieferkette zusammenarbeiten, um die ordnungsgemäße Handhabung und Lieferung temperaturempfindlicher Fracht sicherzustellen. Um diese Herausforderung zu meistern, müssen die Entwickler von Zell- und Gentherapien mit Logistikanbietern zusammenarbeiten, die über mehrere Logistikzentren an strategischen Standorten verfügen, um den Serviceanforderungen gerecht zu werden und das Kühlkettenrisiko zu minimieren.
Einhaltung von Vorschriften
Ein weiterer komplexer Bereich, den es zu berücksichtigen gilt, sind die Gesetze und Richtlinien für die Ein- und Ausfuhr von pharmazeutischen Produkten. Abgesehen von den individuellen Vorschriften für den Transport von Zell- und Gentherapien müssen auch die Anforderungen internationaler Organisationen wie der IATA für den Lufttransport oder des ADR für den Straßentransport für pharmazeutische Produkte angemessen erfüllt werden. Diese Vorschriften können je nach Region und Standort sehr unterschiedlich sein, und es muss besonders darauf geachtet werden, dass diese Anforderungen erfüllt werden.
Die richtige Verpackung
Für den Transport von Zellen und genetischen Behandlungen sind spezielle Verpackungen erforderlich, die unabhängig von der äußeren Umgebung gefrierende oder kalte Temperaturen aufrechterhalten können. Die Nutzlasten werden über verschiedene Terrains, Temperaturen und Feuchtigkeitsniveaus für unterschiedliche Zeiträume transportiert. Daher ist es wichtig, eine Verpackung mit einem angemessenen Wärmeschutzniveau zu verwenden, um die Unversehrtheit der Proben während der gesamten Reise zu gewährleisten. Verbundene Verpackungen mit angemessenen Nachverfolgungs- und Überwachungsfunktionen sind unerlässlich, um die Sichtbarkeit der Nutzlast während des Transports zu gewährleisten, so dass die notwendigen Maßnahmen ergriffen werden können, um Temperaturschwankungen zu vermeiden.
Komplexität der Lieferketten
Da klinische Zell- und Genversuche in vielen Ländern und Regionen durchgeführt werden, stellt die Komplexität der Lieferketten und der Kühlketteninfrastruktur an verschiedenen Standorten eine erhebliche Herausforderung dar. Ein Beispiel wären Entwicklungsländer und -regionen, in denen die Kühlketteninfrastruktur und -logistik nicht so robust und sicher sind. In diesen Szenarien sind Temperaturschwankungen sehr viel häufiger, und die Möglichkeit einer Beschädigung der Nutzlast wird immer dringlicher.
Diese Art der Komplexität der Lieferkette erschwert die Erzielung von Skaleneffekten und macht den Aufbau eines robusten und stabilen Kühlkettenlogistiknetzes sehr viel schwieriger. Die Risikominderung entlang der Lieferkette ist komplexer geworden und erfordert eine wesentlich größere Sorgfalt und Fachkenntnis. Datenerfassung, -management und -automatisierung sind der Weg, um dieses Problem zu lösen. Zell- und Genentwickler, Hersteller und Logistiker müssen ein nahtloses Netzwerk schaffen, in dem Informationen leicht abgerufen, ausgetauscht und gespeichert werden können, um die Transparenz der Lieferkette zu erhalten.
Wie können die Lösungen von Intelsius die Zell- und Gentherapieindustrie unterstützen?
Leistungsstarke ORCA-Reihe
Die ORCA-Baureihe von Intelsius besteht aus vakuumisolierten Paneelen (VIP) in Kombination mit modernen Phasenwechselmaterialien (PCM). Sie ist speziell für den Transport hochwertiger Nutzlasten wie Stammzellen und genetisches Material bei niedrigen und gefrorenen Temperaturen ausgelegt. Das ORCA-Sortiment ist in fünf verschiedene Produkttypen unterteilt, die Temperaturbereiche von -70°C mit Trockeneis, 2-8°C und 15-25°C abdecken, um den spezifischen Temperaturanforderungen Ihrer Nutzlast gerecht zu werden. Die Produkte werden in unseren ISTA-zertifizierten Labors getestet und qualifiziert und garantieren einen Wärmeschutz von bis zu 120 Stunden. Die Größen reichen von der handgehaltenen ORCA Response bis zu unserer vollständig zusammenklappbaren ORCA Pallet-Lösung. Das Sortiment umfasst auch Optionen für den einmaligen und mehrfachen Gebrauch, um alle Anforderungen Ihrer Lieferkette zu erfüllen.

Vernetzte Verpackungslösungen
ORCA Connect ist unsere vernetzte Verpackungslösung, die mit einer Vielzahl von Datenloggern kompatibel ist, so dass Sie Ihre Ladung auf dem Transportweg effizient und effektiv verfolgen können. ORCA Connect gibt Ihnen die Flexibilität, Ihre Sendung so zu verfolgen, wie Sie es wünschen. Mit Echtzeit-Tracking-Funktionen können Sie wichtige Daten wie Außen- und Innentemperatur, Standort, Ausrichtung, Stöße und Licht während der gesamten Reise der Ladung überwachen.

Kunden können auch unser universelles Logger-Portal ORCA Cloud nutzen, das es ihnen ermöglicht, mehrere Datenlogger überall auf der Welt zu verfolgen und darüber zu berichten, so dass sie einen vollständigen Überblick über ihre Nutzlast haben, ohne mehrere Portale zu benötigen. Das einfach zu navigierende Portal bietet Kunden eine nahtlose Möglichkeit, alle wichtigen Daten an einem Ort aufzuzeichnen, insbesondere wenn sie mehrere Nutzlasten haben, die über mehrere Standorte hinweg verfolgt werden müssen – wie z. B. während einer klinischen Studie. Dieser Service ist besonders nützlich als Komplettlösung für die Verwaltung und Überwachung hochwertiger Nutzlasten, wie sie bei Zell- und Gentherapien verwendet werden.
Globale Produktionspräsenz
Intelsius ist seit über 25 Jahren in der Branche für Kühlketten-Verpackungslösungen tätig und verfügt heute über eine Präsenz auf mehreren Kontinenten und an mehreren Standorten. Unsere Produkte und Dienstleistungen sind derzeit an strategischen Standorten in Großbritannien, Europa, Asien, Ozeanien, Afrika sowie Nord- und Südamerika erhältlich. Außerdem haben wir Niederlassungen und Vertriebspartner an strategischen Standorten in der ganzen Welt, auf deren vollständige Liste Sie hier zugreifen können. Unser globaler Produktionsstandort ist Teil unserer Strategie, die Kosten für unsere Kunden zu senken, Risiken in der Lieferkette zu minimieren und unseren ökologischen Fußabdruck zu verringern.
Nehmen Sie Kontakt auf
Wenn Sie mehr über unsere Intelsius-Filialen, unsere anderen temperaturgesteuerten Verpackungslösungen oder darüber erfahren möchten, wie wir Ihre Anforderungen in der Zell- und Gentherapie unterstützen können, wenden Sie sich an cs@intelsius.com. Unsere Kundenbetreuer helfen Ihnen gerne weiter.
External Sources
- https://www.ucl.ac.uk/therapeutic-innovation-networks/education-centre/cell-gene-therapy-translation-roadmap
- https://www.biocair.com/en/knowledge/thought-leadership-technical-articles/the-challenges-of-cell-and-gene-logistics
- https://cerbaresearch.com/app/uploads/2023/08/CellGene_Viroclinics-DDL-1.pdf
- https://www.labiotech.eu/partner/cold-chain-logistics-cell-gene-therapy/
- https://alliancerm.org/wp-content/uploads/2024/01/20231220_Sector-Snapshot-Outline-Fall-2023_V2.pdf
- https://www.asgct.org/global/documents/asgct-citeline-q4-2023-report.aspx#:~:text=In%20Q4%2C%20the%20number%20of,approvals%20for%20COVID%2D19%20vaccines.